量子点荧光定量Western Blot
免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测的方法。与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记物标记的二抗,具有分辨率和实用性高,特异性强等优点。
目前常用的免疫印迹显色方法有:酶促底物化学发光和近红外荧光法,化学发光法一般采用辣根过氧化酶(HRP)标记的二抗加化学发光底物(ECL)显影,化学发光信号需要采用胶片曝光、定影等复杂操作步骤,或者化学发光成像设备进行曝光成像,显影过程较复杂,且检测信号容易过曝或太弱无法检测。而近红外荧光法发采用近红外染料标记的二抗与膜上的一抗反应后,然后进行激光近红外荧光扫描仪成像,克服了传统荧光二抗检测灵敏度较低,化学发光法操作步骤复杂、需要发光底物、容易过度曝光等缺点。但近红外荧光染料稳定性差,实验操作需要全程避光进行;且需要价格昂贵近红外荧光成像仪器进行显影。且不同的染料需要不同波长的光源激发,使得成像仪器复杂化。
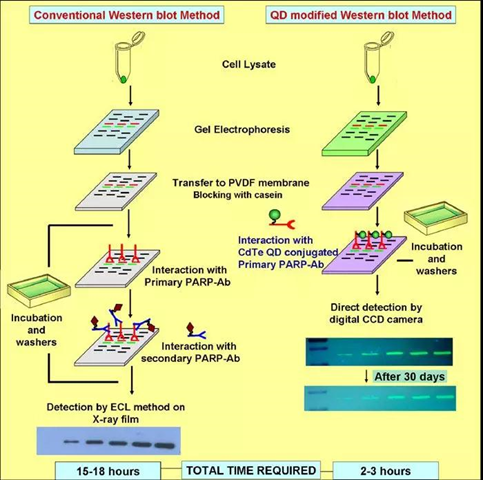
量子点(Quantum dot)作为一种新型荧光无机纳米晶体,具有宽的激发谱和窄的发射谱,光学稳定性高,生物相容性好等优点。量子点经过各种化学修饰之后,可以进行特异性连接,其细胞毒性低,对生物危害小,可以进行生物活体标记和检测。连接有蛋白或二抗的量子点在免疫印迹中可以作为优良的荧光成像剂,其光稳定性强,信号稳定,适合高质量分析。单一的紫外激发光源可以激发发射波长在490 nm~680 nm范围内的 ,在同一系统中实现多色检测,并且利用亲和素-生物素系统,放大荧光效应。
2005年,Ornberg等首次报道量子点免疫印迹技术,利用不同发射波长的量子点标记二抗检测MAPK(丝裂原活化蛋白激酶)和磷酸化的MAPK,实现在同一印迹中同时观察到绿色和红色条带,并检测到MAPK蛋白浓度与荧光强度有线性关系。该方法灵敏度高,可多重标记,光化学性能稳定,耗时短。Scholl等用传统免疫印迹检测神经生长因子时,检测为10 ng,而基于量子点的免疫印迹可将检测限降低至0.01 ng。
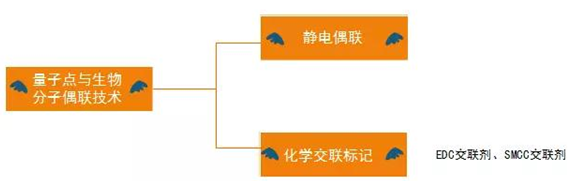
量子点与生物分子的偶联技术
量子点与生物分子的偶联技术可以归纳为以下两种:
量子点免疫印迹的应用
目标蛋白的定性检测
Bakalova等采用2种量子点免疫印迹模式检测白血病K-562细胞中的TRF,Tin2和β-肌动蛋白。单模式(量子点直接偶联蛋白)时,CdSe量子点分别直接偶联不同浓度的抗TRF 1 抗体、抗Tin 2、抗β-肌动蛋白,“夹层模式”采用亲和素-生物素系统使量子点间接与抗体连接。两种模式下,免疫印迹均可得到不同荧光强度的条带,待测蛋白浓度与荧光强度成正相关,且夹层模式比单模式下荧光强度更强,信号放大作用显著,检测结果更灵敏。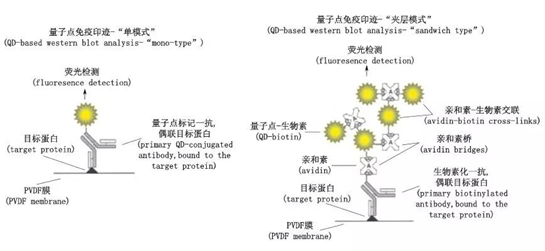
蛋白质的定量检测
量子点免疫印迹克服了传统免疫印迹只能做半定量分析的局限,通过建立待测蛋白浓度与相对荧光强度的标准曲线,即可实现对微量蛋白的定量分析。Kale等用量子点标记前列腺凋亡反应基(Par-4)、聚(ADP-核糖)聚合酶和β肌动蛋白抗体,特异性分析细胞核和细胞质中的蛋白质,检测限可低至 10 pg。
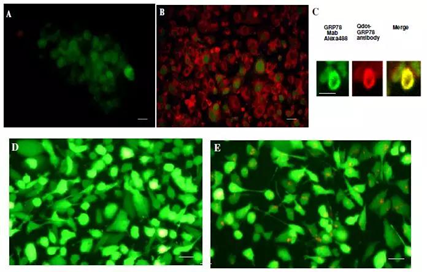
蛋白-蛋白、 蛋白-DNA间互作、蛋白质-RNA相互作用后续分析
在体外,通过量子点免疫印迹判断生物分子是否与目标物质结合,为生物分子的体内研究做铺垫。Xu等将量子点连接小抗体片段后特异性标记膜结合蛋白(GRP78),用免疫印迹测试量子点-抗GRP78的特异性,在紫外灯下检测到1条荧光强度很高的红色条带,随后体内研究GRP78带动量子点-抗GRP78从细胞进入细胞质,有效地被癌细胞内化,表现出抑制乳腺癌生长的生物抗肿瘤活性。
量子点免疫印迹分析是近10年来发展起来的新技术,除了应用于蛋白质定性或定量检测,在生物医药学领域中的应用也展示出广阔的前景。其有利于推动药物靶向系统的开发与研制,实现在活体内实时研究药物与体内多种细胞以及细胞的多种生物分子的相互作用,更深入研究药物的体内过程。
诚如以上概述,量子点荧光免疫印迹是蛋白质定量或定性研究、蛋白质与其他生物分子互作的热点与创新点。如果您对这方面研究感兴趣,昆道生物即将推出量子点荧光二抗,敬请期待!
您的荧光免疫印迹之路,昆道生物伴您同行。
参考文献:
周玮婷, 曹霞, 余江南,等. 药物分析杂志, 2015(4):569-574.
Xu W, Liu L, Brown N J, et al. Molecules, 2012, 17(1):796-808.
MAKRIDES SC,GASBARRO C,BELLO JM. BioTechniques,2005,39(4): 501.
Kale S, Kale A, Gholap H, et al. Journal of Nanoparticle Research, 2012, 14(3):732.